
IA Act – Quel impact sur les dispositifs intégrant des systèmes d’intelligence artificielle ?
Vous fabriquez des dispositifs intégrant des systèmes d’intelligence artificielle et vous vous demandez en quoi l’IA Act, fraichement publié, va vous impacter ? Lisez la suite de cet article 😉
Le message clé à retenir : Les Règlements DM et DIV continuent de piloter les DM/DIV intégrant de l’IA !
-
-
-
- L’IA Act est basé sur une approche « horizontale », non spécifique à un secteur d’activité particulier.
- Contrairement aux RDM/RDIV qui sont basés sur une approche sectorielle « verticale » de la règlementation, spécifique à un type de produit
-
-
Cela signifie que, pour un dispositif intégrant un système d’IA :
-
-
-
- Les aspects et exigences spécifiques à l’IA sont définis par l’IA Act
- La sécurité globale du produit final est couverte par le RDM/RDIV
- La conformité des systèmes d’IA aux exigences de l’IA Act sera évaluée dans le cadre de l’évaluation de la conformité déjà prévue par le RDM/RDIV
-
-
Comme pour les RDM/RDIV, la classification de l’IA Act est basée sur le niveau de risques du produit :
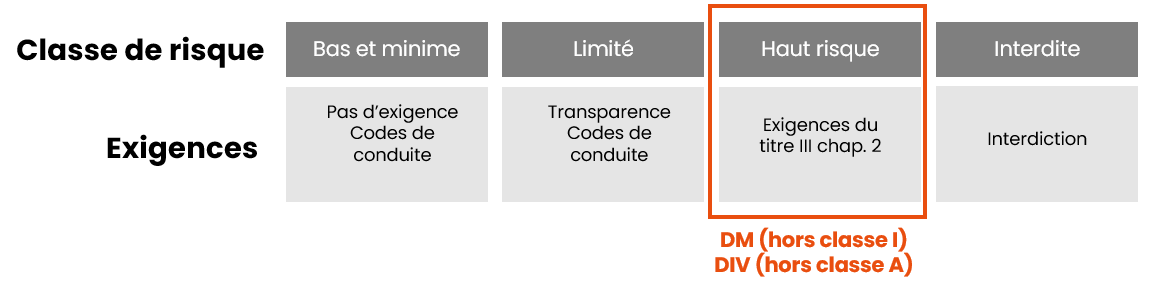
Retenez que les dispositifs intégrant un système d’IA (sauf les DM de classe I, et les DIV de classe A) sont automatiquement classés comme systèmes d’IA à haut risque selon l’IA Act, sans tenir compte de leur classe de risque en vertu du RDM/RDIV. Cette classification à haut risque engendre une revue systématique de la documentation technique lors de l’évaluation de la conformité.
2 exceptions tout de même :
-
-
-
- les DM de classe I (qui ne sont pas stériles, n’ont pas de fonction de mesurage et qui ne sont pas des instruments chirurgicaux réutilisables) et les DIV de classe A non stériles
- les legacy devices
-
- qui ne sont pas des systèmes d’IA à haut risque et ne sont pas soumis à une procédure d’évaluation de la conformité en vertu de l’IA Act.
- Mais qui doivent tout de même appliquer les exigences du Titre IV de l’IA Act : obligation de transparence vis-à-vis des personnes concernées sur le fait qu’elles interagissent avec un système d’IA, à moins que cela soit évident.
-
-
-
De nombreuses exigences sont communes entre les deux textes (RDM/RDIV et IA Act)
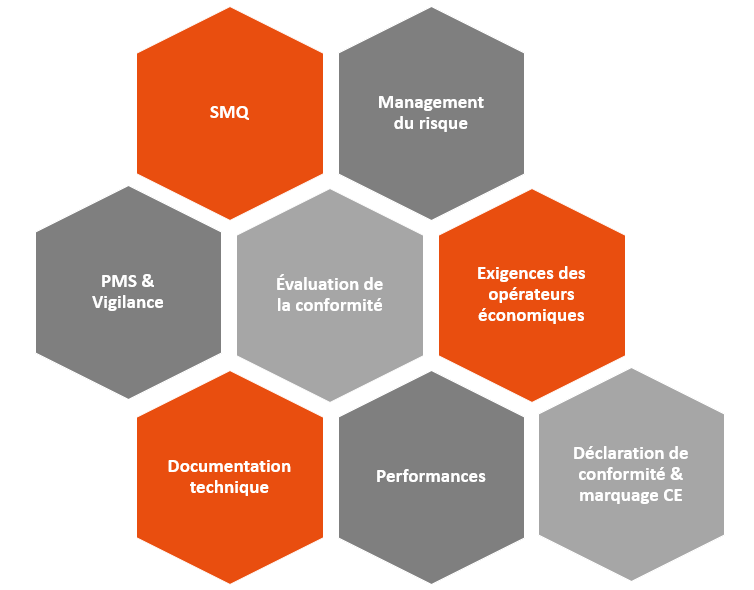
Mais… on a aussi quelques nouveautés qui vont impacter les fabricants de dispositifs intégrant des SIA, notamment :
-
-
-
- La gouvernance des données: Les SIA à haut risque doivent être développés en utilisant des ensembles de données de haute qualité pour l’apprentissage, la validation et les tests.
- Le contrôle humain: Les SIA à haut risque doivent être conçus de manière à permettre aux humains de les superviser efficacement à outils d’interface homme-machine appropriés
- La précision, la robustesse et la cybersécurité : qui doivent être maintenus tout au long du cycle de vie des SIA à haut risque
-
-
Et enfin, voici les dates d’application à retenir, en fonction de la classe des dispositifs :
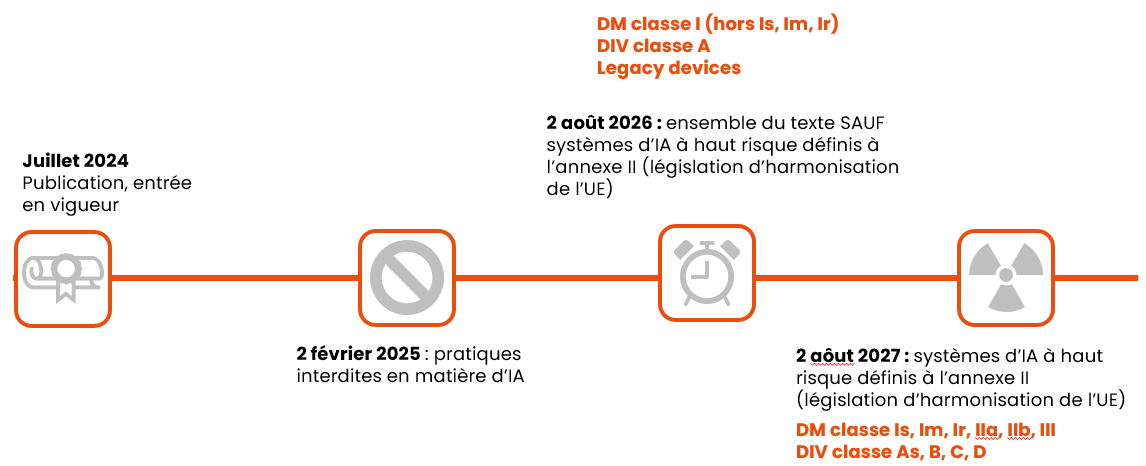
Si vous souhaitez en savoir plus :
-
-
-
- Webinar sur l’articulation entre l’IA Act et les RDM/RDIV a récemment été animé par nexialist
- Découvrez nos podcasts
- Notre rubrique IA avec l’ensemble des textes règlementaires, normatifs ou des guides, à l’échelle internationale
-
-
En savoir plus sur le monde du DM & DMDIV
Nos articles récents
Proposition de directive relative à l’adaptation des règles en matière de responsabilité civile extracontractuelle au domaine de l’intelligence artificielle
Proposition de directive relative à l’adaptation des règles en matière de responsabilité civile extracontractuelle au domaine de l’intelligence artificielle Proposition de directive relative à l’adaptation des règles en matière de responsabilité civile...
Nouvelles règles pour l’intelligence artificielle – Questions et réponses
Nouvelles règles pour l'intelligence artificielle - Questions et réponses Nouvelles règles pour l'intelligence artificielleLes nouvelles règles pour l'intelligence artificielle sont un ensemble de lignes directrices élaborées par la Commission européenne pour...
Proposition de règlement sur l’intelligence artificielle
Proposition de règlement sur l'intelligence artificielle Règlement sur l'intelligence artificielleLa publication en avril 2021 de la proposition de règlement européen sur l’intelligence artificielle par la Commission Européenne s’inscrit dans une volonté globale...

0 commentaires