
IA Act – Quel impact sur les dispositifs intégrant des systèmes d’intelligence artificielle ?
Vous fabriquez des dispositifs intégrant des systèmes d’intelligence artificielle et vous vous demandez en quoi l’IA Act, fraichement publié, va vous impacter ? Lisez la suite de cet article 😉
Le message clé à retenir : Les Règlements DM et DIV continuent de piloter les DM/DIV intégrant de l’IA !
-
-
-
- L’IA Act est basé sur une approche « horizontale », non spécifique à un secteur d’activité particulier.
- Contrairement aux RDM/RDIV qui sont basés sur une approche sectorielle « verticale » de la règlementation, spécifique à un type de produit
-
-
Cela signifie que, pour un dispositif intégrant un système d’IA :
-
-
-
- Les aspects et exigences spécifiques à l’IA sont définis par l’IA Act
- La sécurité globale du produit final est couverte par le RDM/RDIV
- La conformité des systèmes d’IA aux exigences de l’IA Act sera évaluée dans le cadre de l’évaluation de la conformité déjà prévue par le RDM/RDIV
-
-
Comme pour les RDM/RDIV, la classification de l’IA Act est basée sur le niveau de risques du produit :
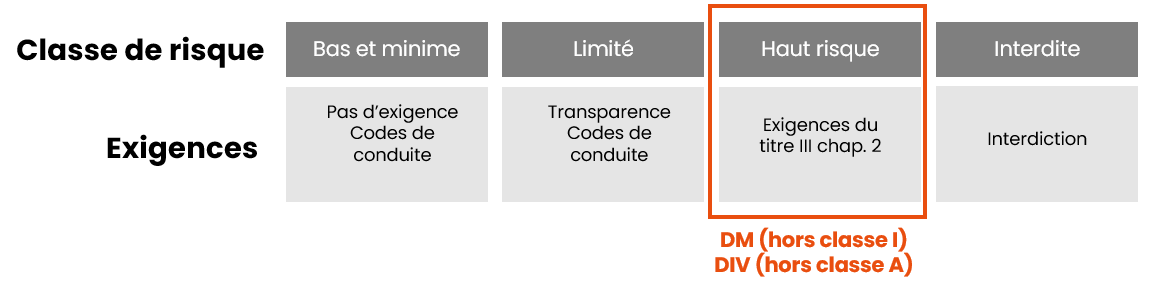
Retenez que les dispositifs intégrant un système d’IA (sauf les DM de classe I, et les DIV de classe A) sont automatiquement classés comme systèmes d’IA à haut risque selon l’IA Act, sans tenir compte de leur classe de risque en vertu du RDM/RDIV. Cette classification à haut risque engendre une revue systématique de la documentation technique lors de l’évaluation de la conformité.
2 exceptions tout de même :
-
-
-
- les DM de classe I (qui ne sont pas stériles, n’ont pas de fonction de mesurage et qui ne sont pas des instruments chirurgicaux réutilisables) et les DIV de classe A non stériles
- les legacy devices
-
- qui ne sont pas des systèmes d’IA à haut risque et ne sont pas soumis à une procédure d’évaluation de la conformité en vertu de l’IA Act.
- Mais qui doivent tout de même appliquer les exigences du Titre IV de l’IA Act : obligation de transparence vis-à-vis des personnes concernées sur le fait qu’elles interagissent avec un système d’IA, à moins que cela soit évident.
-
-
-
De nombreuses exigences sont communes entre les deux textes (RDM/RDIV et IA Act)
Mais… on a aussi quelques nouveautés qui vont impacter les fabricants de dispositifs intégrant des SIA, notamment :
-
-
-
- La gouvernance des données: Les SIA à haut risque doivent être développés en utilisant des ensembles de données de haute qualité pour l’apprentissage, la validation et les tests.
- Le contrôle humain: Les SIA à haut risque doivent être conçus de manière à permettre aux humains de les superviser efficacement à outils d’interface homme-machine appropriés
- La précision, la robustesse et la cybersécurité : qui doivent être maintenus tout au long du cycle de vie des SIA à haut risque
-
-
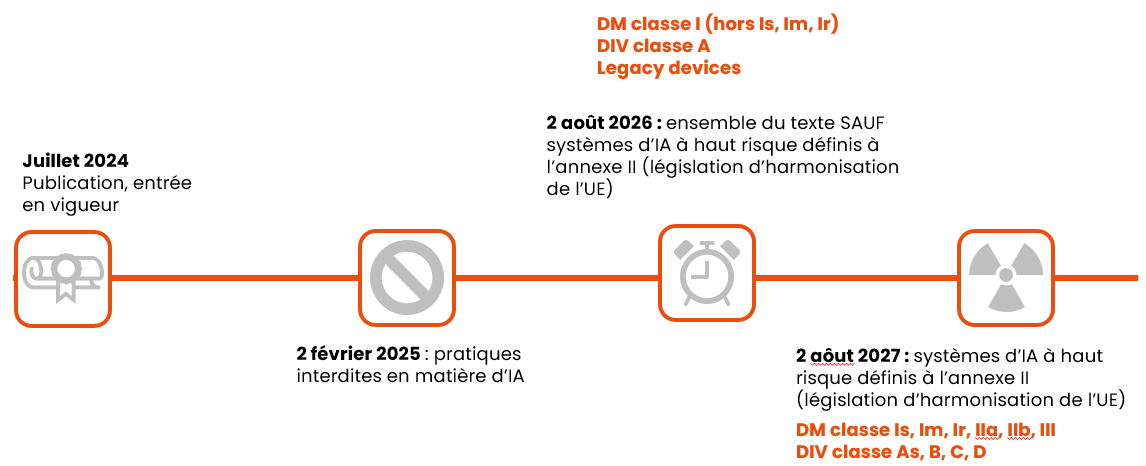
Et enfin, voici les dates d’application à retenir, en fonction de la classe des dispositifs :
Si vous souhaitez en savoir plus :
-
-
-
- Webinar sur l’articulation entre l’IA Act et les RDM/RDIV a récemment été animé par nexialist
- Découvrez nos podcasts
- Notre rubrique IA avec l’ensemble des textes règlementaires, normatifs ou des guides, à l’échelle internationale
-
-
En savoir plus sur le monde du DM & DMDIV
Nos articles récents
Directive (UE) 2024/2853 relative à la responsabilité du fait des produits défectueux : quelles nouveautés pour les fabricants de DM et de DIV ?
A l'aube de ses 40 ans, la Directive relative à la responsabilité du fait des produits défectueux se renouvelle pour s’adapter aux innovations technologiques, lutter contre les incohérences juridiques et garantir une cohérence législative au sein de l’UE. Publiée au...
Suisse : l’ODIV modifiée pour s’adapter à l’extension des dispositions transitoires européennes & les évolutions à venir !
L’ordonnance suisse sur les dispositifs médicaux de diagnostic in vitro (ODiv) a été modifiée par la décision RO 2024 741 du Conseil fédéral du 20 novembre 2024, qui est entrée en vigueur le 1er janvier 2025. Retrouvez le texte final ici ! Mais alors, quelles sont les...
UE – MDCG 2024-15 – Guidance on the publication of the clinical investigation reports and their summaries in the absence of EUDAMED – Novembre 2024
Thème Rapport d’investigation clinique Public visé Promoteur, autorités compétentes, Commission Produits concernés DM Référence Réglementaire RDM (UE) 2017/745 – Art 77 MDCG 2021-1 Rev1 Ce guide explique la procédure à suivre pour publier les rapports...



0 commentaires