
IA Act – Quel impact sur les dispositifs intégrant des systèmes d’intelligence artificielle ?
Vous fabriquez des dispositifs intégrant des systèmes d’intelligence artificielle et vous vous demandez en quoi l’IA Act, fraichement publié, va vous impacter ? Lisez la suite de cet article 😉
Le message clé à retenir : Les Règlements DM et DIV continuent de piloter les DM/DIV intégrant de l’IA !
-
-
-
- L’IA Act est basé sur une approche « horizontale », non spécifique à un secteur d’activité particulier.
- Contrairement aux RDM/RDIV qui sont basés sur une approche sectorielle « verticale » de la règlementation, spécifique à un type de produit
-
-
Cela signifie que, pour un dispositif intégrant un système d’IA :
-
-
-
- Les aspects et exigences spécifiques à l’IA sont définis par l’IA Act
- La sécurité globale du produit final est couverte par le RDM/RDIV
- La conformité des systèmes d’IA aux exigences de l’IA Act sera évaluée dans le cadre de l’évaluation de la conformité déjà prévue par le RDM/RDIV
-
-
Comme pour les RDM/RDIV, la classification de l’IA Act est basée sur le niveau de risques du produit :
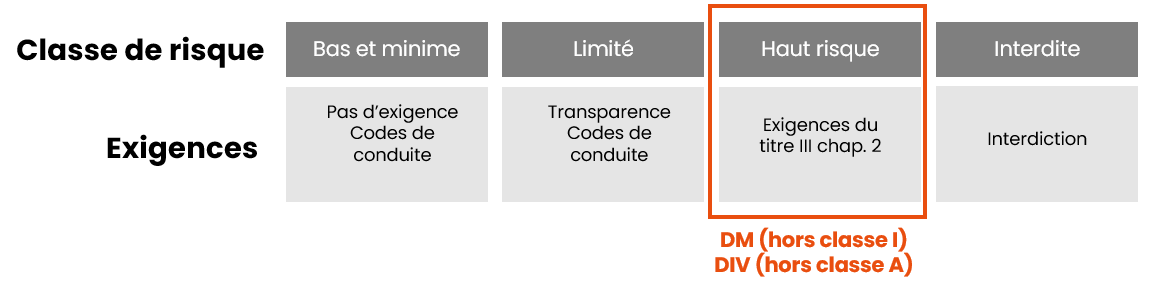
Retenez que les dispositifs intégrant un système d’IA (sauf les DM de classe I, et les DIV de classe A) sont automatiquement classés comme systèmes d’IA à haut risque selon l’IA Act, sans tenir compte de leur classe de risque en vertu du RDM/RDIV. Cette classification à haut risque engendre une revue systématique de la documentation technique lors de l’évaluation de la conformité.
2 exceptions tout de même :
-
-
-
- les DM de classe I (qui ne sont pas stériles, n’ont pas de fonction de mesurage et qui ne sont pas des instruments chirurgicaux réutilisables) et les DIV de classe A non stériles
- les legacy devices
-
- qui ne sont pas des systèmes d’IA à haut risque et ne sont pas soumis à une procédure d’évaluation de la conformité en vertu de l’IA Act.
- Mais qui doivent tout de même appliquer les exigences du Titre IV de l’IA Act : obligation de transparence vis-à-vis des personnes concernées sur le fait qu’elles interagissent avec un système d’IA, à moins que cela soit évident.
-
-
-
De nombreuses exigences sont communes entre les deux textes (RDM/RDIV et IA Act)
Mais… on a aussi quelques nouveautés qui vont impacter les fabricants de dispositifs intégrant des SIA, notamment :
-
-
-
- La gouvernance des données: Les SIA à haut risque doivent être développés en utilisant des ensembles de données de haute qualité pour l’apprentissage, la validation et les tests.
- Le contrôle humain: Les SIA à haut risque doivent être conçus de manière à permettre aux humains de les superviser efficacement à outils d’interface homme-machine appropriés
- La précision, la robustesse et la cybersécurité : qui doivent être maintenus tout au long du cycle de vie des SIA à haut risque
-
-
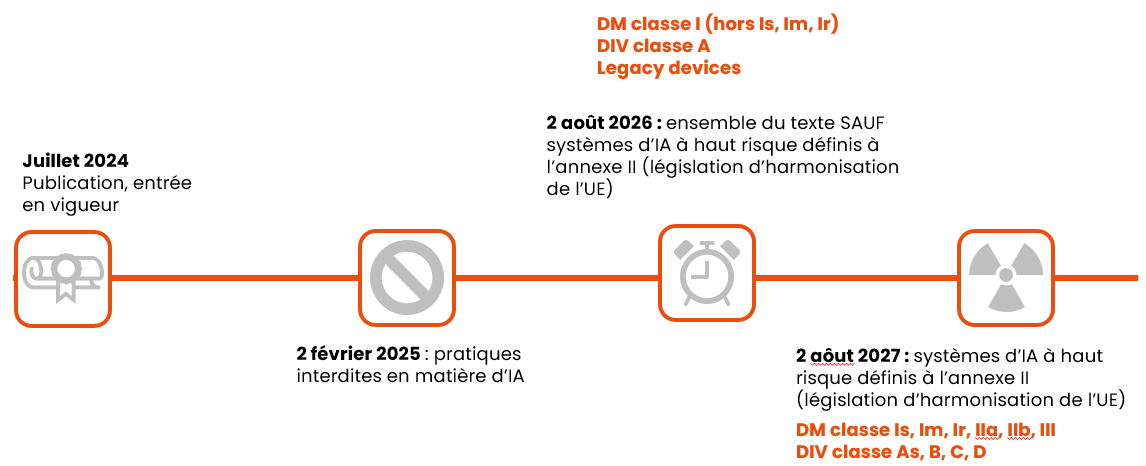
Et enfin, voici les dates d’application à retenir, en fonction de la classe des dispositifs :
Si vous souhaitez en savoir plus :
-
-
-
- Webinar sur l’articulation entre l’IA Act et les RDM/RDIV a récemment été animé par nexialist
- Découvrez nos podcasts
- Notre rubrique IA avec l’ensemble des textes règlementaires, normatifs ou des guides, à l’échelle internationale
-
-
En savoir plus sur le monde du DM & DMDIV
Nos articles récents
MDCG 2022-20 Substantial modification of performance study under Regulation (EU) 2017/746 – Décembre 2022
Thème Modification substantielle d’une étude des performances Public visé Promoteurs, Autorités compétentes Produits concernés DIV Référence Réglementaire RDIV (UE) 2017-746 Article 66(1) Article 70(1) Article 71 Documents cités MDCG 2022-19 La base de données...
MDCG 2022-19 Performance study application/notification documents under Regulation (EU) 2017/746 – Décembre 2022
Thème Demande/soumission d’une étude des performances Public visé Promoteurs, Autorités compétentes Produits concernés DM Référence réglementaire RDIV (UE) 2017/746 Article 66 Article 69 Article 70(1) Documents cités MDCG 2022-12 Le MDCG rappelle toutefois que...
MDCG 2022-18 : MDCG Position Paper on the application of Article 97 MDR to legacy devices for which the MDD or AIMDD certificate expires before the issuance of a MDR certificate – Décembre 2022
Thème Dispositifs legacy Public visé Fabricants, Organismes notifiés Produits concernés DM Référence Réglementaire RDM (UE) 2017/745 Référence réglementaire RDM (UE) 2017/745 Article 52 Article 120(3) Article 94 Documents cités MDCG 2021-25 MDCG 2020-3 Synthèse :...

0 commentaires