Mise sur le marché, mise à disposition sur le marché, mise en service… Vous ne comprenez pas les subtilités de ce vocabulaire ? Ces notions sont pourtant omniprésentes dans les règlements relatifs aux dispositifs médicaux (DM) et aux dispositifs médicaux de diagnostic in vitro (DMDIV). Leur compréhension est essentielle pour maitriser les dispositions transitoires et optimiser ainsi la commercialisation de vos dispositifs certifiés conformément aux directives.
nexialist décrypte ces notions pour vous permettre d’appréhender sereinement votre transition.
Pour commencer, penchez-vous en détail sur les définitions (Art 2 des Règlement DM et DMDIV).
- Mise sur le marché : « la première mise à disposition d’un dispositif sur le marché de l’Union »
- Mise à disposition sur le marché : « toute fourniture d’un dispositif destiné à être distribué, consommé ou utilisé sur le marché de l’Union dans le cadre d’une activité commerciale, à titre onéreux ou gratuit »
- Mise en service : « le stade auquel un dispositif est mis à la disposition de l’utilisateur final, […] étant prêt à être utilisé pour la première fois sur le marché de l’Union conformément à sa destination »
Le premier constat que l’on peut faire, c’est que ces trois notions sont étroitement liées :
- La mise sur le marché est la première mise à disposition sur le marché,
- La mise en service est le stade final de la mise à disposition
Ne décrochez pas ! nexialist est là pour vous aider.
I-Focus sur la mise sur le marché
La mise sur le marché est une opération réservée soit au fabricant, soit à un importateur, puisque seuls ces opérateurs économiques sont habilités à mettre à disposition pour la première fois un dispositif sur le marché de l’Union.
Pour être mis sur le marché, un dispositif doit être conforme à la réglementation (certificat de conformité délivré par un organisme notifié ou déclaration (UE) de conformité pour les DM de classe I / DMDIV de classe A). Par ailleurs, les dispositifs importés doivent être autorisés pour libre circulation dans le marché intérieur.
Mais ces étapes ne sont pas suffisantes pour que votre dispositif soit considéré comme « mis sur le marché ». Pour qu’il le soit, il faut qu’il ait intégré la chaîne de distribution. Ainsi, la mise sur le marché a lieu lorsque le produit est « cédé », au terme de la phase de fabrication, en vue de sa distribution ou de son utilisation sur le territoire communautaire. Le produit est considéré comme étant cédé lors d’un transfert physique ou après un transfert de propriété.
II-Focus sur la mise à disposition sur le marché
Cette action est exclusivement réservée au distributeur, comme le précise la définition qui lui est consacrée dans le Règlement : « toute personne physique ou morale faisant partie de la chaîne d’approvisionnement, autre que le fabricant ou l’importateur, qui met un dispositif à disposition sur le marché, jusqu’au stade de sa mise en service. ».
La mise à disposition sur le marché a lieu après la mise sur le marché, qui rappelons-le, est la première fourniture un dispositif sur le marché l’Union européenne.
La mise à disposition sur le marché suppose de nouveau un transfert de propriété ou un transfert physique du dispositif.
III-Focus sur la mise à service
La mise en service est effective au moment de la première utilisation du dispositif par l’utilisateur final (patient ou professionnel de santé). Les opérateurs économiques peuvent intervenir jusqu’au stade de la mise en service dans la mesure où ils fournissent à l’utilisateur final un dispositif prêt à être utilisé.
Vous êtes perdus ? Consultez notre schéma !
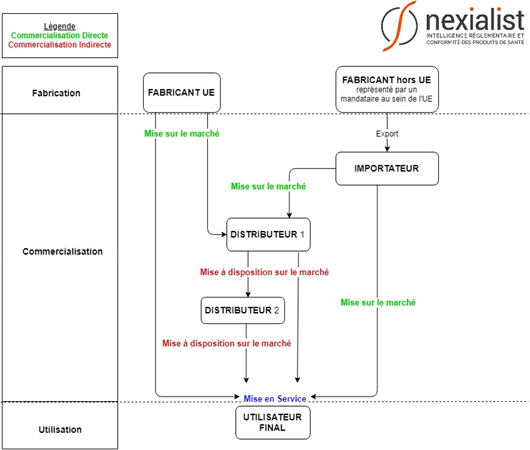
Pourquoi la compréhension de ces trois notions est essentielle ?
Des dates différentes sont affectées à ces notions concernant la transition de la Directive au Règlement (Article 120 Règlements DM et DMDIV).
- Après le 27 mai 2024, il ne sera plus possible de mettre sur le marché un dispositif en vertu de la Directive. Passé cette date, les fabricants et les importateurs ne pourront mettre sur le marché que des dispositifs conformes au Règlement.
- En revanche, les dispositifs qui ont déjà été mis sur le marché conformément à la Directive pourront continuer à être mis à disposition sur le marché et mis en service jusqu’au 27 mai 2025. Une aubaine pour les distributeurs qui pourront continuer à liquider leurs stocks.
Sources :
- Règlement (UE) 2017/745 relatif aux dispositifs médicaux
- Règlement (UE) 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro
- Communication de la Commission — Le Guide bleu relatif à la mise en œuvre de la réglementation de l’Union européenne sur les produits 2016
Besoin de conseils ? Contactez-nous !
Par Chloé Dhordain et Astrid Daydou
